自 2025 年 7 月 1 日 起,臺灣化粧品法規正式進入高密度查核階段。針對嬰兒、唇部、眼部等高風險產品類別,TFDA 已明確將清潔驗證(Cleaning Validation)列為 GMP 查核與抽驗的重要關注項目。
在此法規背景下,企業面臨的已不再只是「是否執行清潔作業」,而是:
你的清潔驗證,是否能在查核時清楚說明、具備科學依據,並經得起追問?
法規沒有指定方法,但會檢視「你怎麼證明清潔是有效的」
現行化粧品 GMP 與即將全面實施的 PIF(產品資訊檔案)制度,並未要求企業必須採用特定的清潔驗證技術。然而,TFDA 在實際查核中,關注的重點已明顯轉向以下三個層面:
- 清潔驗證是否與產品風險與製程特性相符
- 所選用的方法,是否能合理反映潛在殘留風險
- 相關數據是否具備可追溯性,並能於查核時清楚說明
也因此,過去僅以單一指標或經驗判斷作為清潔有效性依據的做法,開始面臨可解釋性與完整性不足的挑戰。
當清潔驗證僅依賴單一指標時,可能忽略的殘留風險
在化粧品實際生產環境中,產線殘留風險往往來自胜肽、膠原蛋白、植物萃取物、油脂與粉體等高分子有機成分。這類殘留不僅具備微生物可利用性,也因附著性高、清除困難,成為清潔驗證中最容易被低估的風險來源。
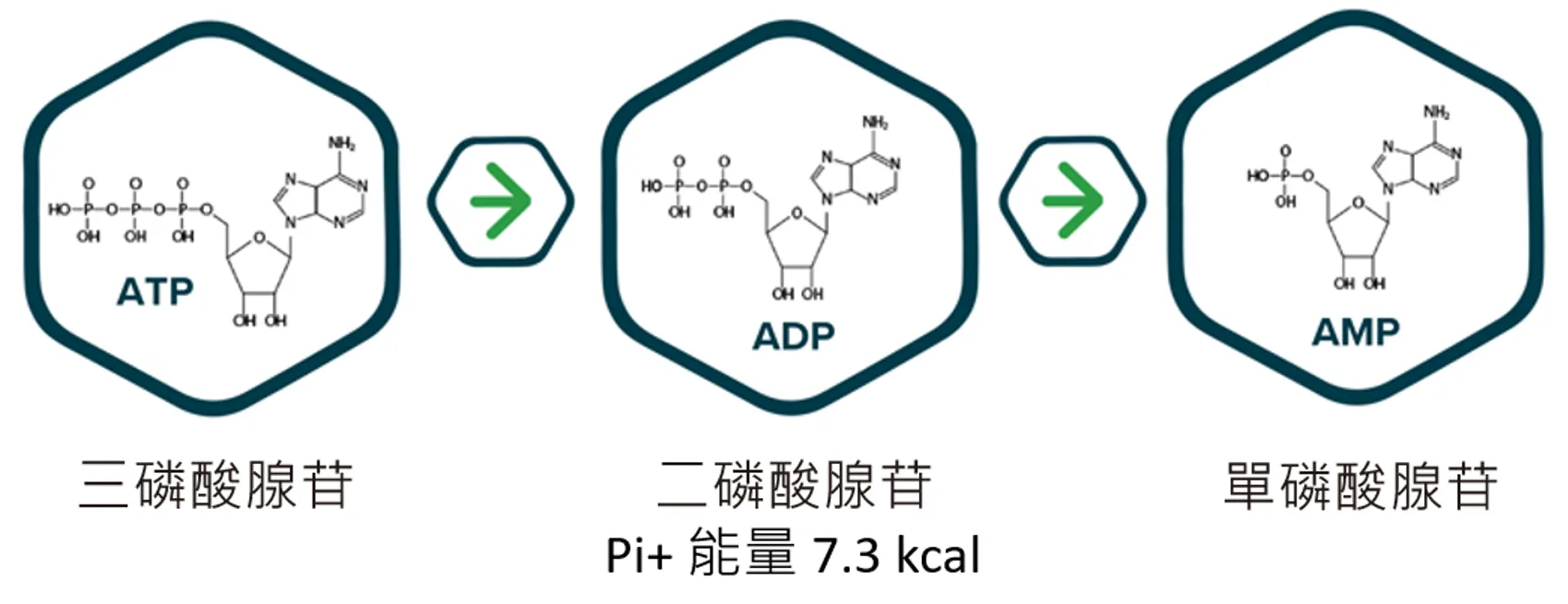
實務上,部分產線會使用 ATP 檢測作為快速評估設備表面潔淨度的工具之一。然而,在攪拌、加熱、乳化、酸鹼調整等實際製程條件影響下,ATP 可能發生降解,使殘留能量以 ADP 或 AMP 等形式存在。
在特定配方與製程情境中,若僅偵測 ATP 本身,可能無法完整反映所有可被微生物利用的殘留狀態。這也是為何部分產品在填充後一段時間,才逐漸出現品質異常或微生物風險的原因之一。因此,單一指標的「數值合格」,並不必然等同於風險已被充分掌握。在風險導向查核體系下,企業必須能說明所選方法的適用範圍與限制,這正是清潔驗證面臨的核心課題。
Kikkoman A3 法: 補足殘留能量評估盲區的進階清潔驗證思維
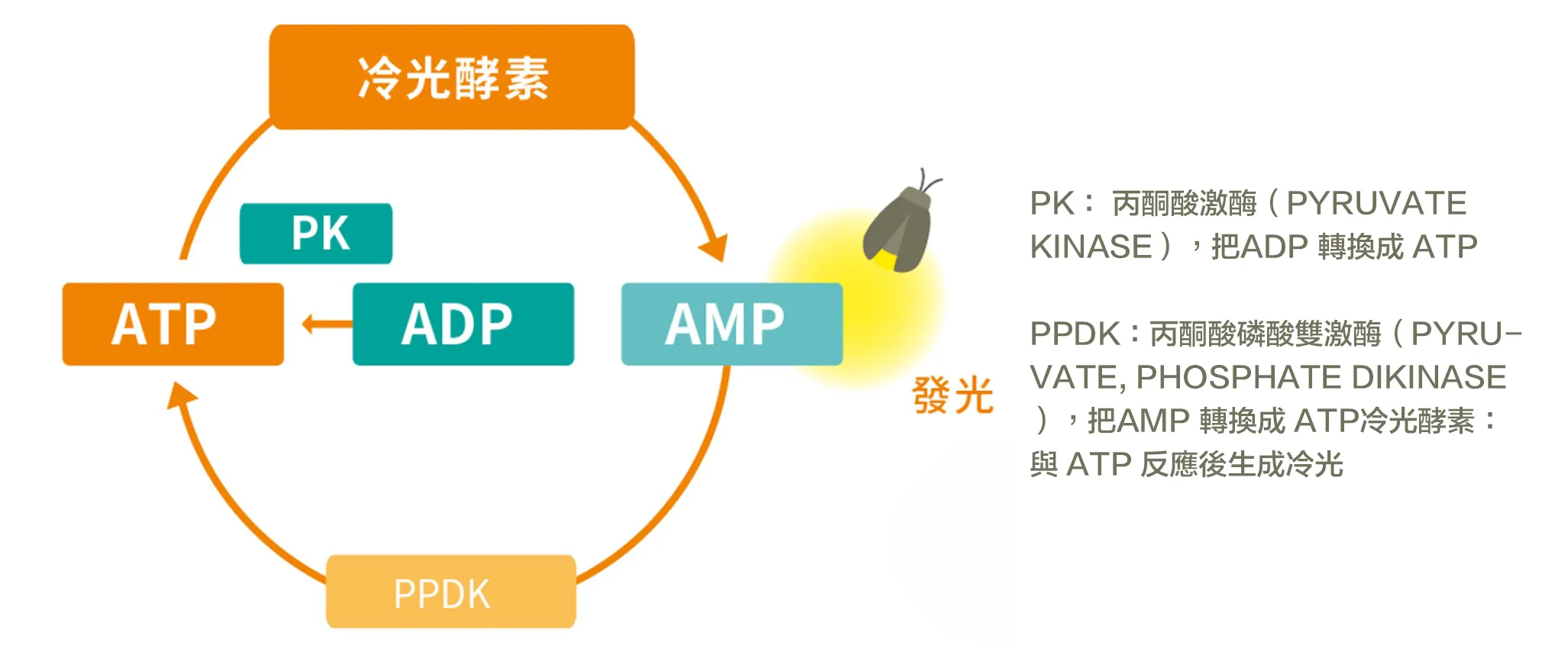
為因應單一能量指標可能存在的結構性盲區,Kikkoman 憑藉近 30 年在 ATP 檢測領域的研究與實務經驗,於 2017 年開發 A3 法清潔驗證技術,將殘留能量的評估範圍,從單一 ATP,擴展至 ATP、ADP 與 AMP。
A3 法透過專利 PPDK(丙酮酸磷酸雙激酶) 與 PK(丙酮酸激酶) 的雙重酵素反應,將殘留中的 ADP 與 AMP 轉化為 ATP,進而進行同步能量偵測,使評估結果更貼近實際可被微生物利用的殘留狀態。
該技術已通過 國際性能驗證方法(PTM)認證(編號:051901),並由第三方實驗室驗證其在多種殘留條件下的檢出能力。其核心價值在於:
輔助企業更完整評估可被微生物利用的殘留能量
提升清潔驗證結果在查核與說明上的完整性
將清潔驗證邏輯,從「是否合格」提升為「是否風險可控」
PIF 制度上路後,清潔驗證數據必須「說得清楚、拿得出來」
隨著 2026 年 PIF(產品資訊檔案)制度全面實施,品牌商將對產品安全性承擔最終責任。這意味著,所有清潔驗證與微生物相關數據,必須同時具備:
- 可追溯性
- 完整性
- 查核時能被清楚說明與佐證
Kikkoman A3 系統所提供的數位化記錄,可完整保存採樣、檢測、數據生成與報告歸檔的全流程紀錄,不僅有助於因應 TFDA 查核,也能在品質爭議或客訴發生時,提供具體且可被採信的科學證據。
從事後補救,走向事前預防的清潔驗證策略
即使設備外觀潔淨,管路彎折處、墊片縫隙及設備結構死角,仍可能因清潔不易而形成生物膜(Biofilm)。在特定條件下,生物膜可降低消毒劑的作用效率,並成為持續釋放微生物污染的潛在來源,常被視為產線重複污染且難以追溯根因的重要因素之一。
透過 BioGlo 細菌生物膜偵測儀所採用的多波段脈衝式紫外光非破壞性偵測技術,可在污染尚未達到肉眼可辨識之前,輔助找出潛在汙染。進一步結合 A3 法清潔驗證,可建立以下以風險為導向的管理模式:
事前預警 × 精準清潔 × 可查核驗證
此一整合策略,使清潔驗證不再僅是問題發生後的補救手段,而能有效前移至風險預防與持續監控層級,協助企業在 GMP 與查核體系下,建立更具科學依據與可追溯性的風險控管機制。
爾榜燈生技:協助你建立可被查核的清潔驗證體系
爾榜燈生技長期深耕化粧品、生技、食品及公部門合規領域,專注協助企業將傳統清潔流程,升級為可被查核的科學化驗證系統。
針對嬰兒、唇部、眼部等高風險產品,我們提供:
- 困難配方殘留的實測與驗證設計
- A3 法清潔驗證系統導入與人員訓練
- 符合 TFDA 與 PIF 要求的微生物數據管理架構
我們的目標,不只是協助企業通過查核,而是讓清潔驗證本身,成為品質與合規管理的長期優勢。




